Es la molécula más abundante de los seres vivos. Aproximadamente, el 70% dependiendo del tipo de organismo (90% en las medusas) y de la edad de la parte del organismo (10% en semillas o 25% en huesos).
2.1 Estructura
Composición : 2H | O. Se unen por enlace covalente (comparten electrones). Presentan una electronegatividad diferente.
El oxígeno atrae a los electrones del enlace con más fuerza que el hidrógeno, con lo cual, los enlaces se distribuyen asimétricamente, lo que produce una carga negativa en el O y cargas positivas en los H.
Aunque es neutra, debería ser apolar (no ganan ni pierden electrones. es electrónicamente neutra.
La distribución asimétrica de los electrones es lo que produce las cargas eléctricas del agua: DIPOLO.
Está eléctricamente cargada. Se forma el enlace covalente dativo.
El dipolo va a explicar las anómalas y vitales propiedades que presenta el agua.
El puente de hidógeno es un enlace por atracciones electromagnéticas entre capas positivas y negativas. Es débil (no se puede comparar con iónico o covalente) pero es el más fuerte de los débiles.
Los puentes de hidógeno, duran milésimas de segundo (están todo el tiempo formándose y rompiéndose). Mantienen unidas 3, 4, 8, 9 moléculas de agua. Éstas no se encuentran aisladas. Unidas forman tetraedros.
2.2 Propiedades y funciones biológicas del agua
I) El agua es líquida a temperatura ambiente. Por esta razón existe la vida.
II) El agua tiene un elevado calor específico.
La temperatura es una medida de la agitación térmica de las moléculas.
Dela energía térmica añadida al agua, parte se consume en romper los puentes de hidrógeno y el resto agita las moléculas (a mayor energía, mayor temperatura). Cualquier calor específico amortigua los cambios de temperatura vitales.
el medio interno es agua. Aquí ocurren intercambios energéticos (metabolismo) sin aumentar la temperatura. Esto, también nos explica el clima (el mar).
III) Elevado calor específico.
Es el paso de líquido a gaseoso. Cuando la agitación de las moléculas alcanza un valor igual de la presión de vapor a la presión atmosférica se hace vapor. Es 500 veces el calor específico. Ésto permite el enfrentamiento por transpiración.
Le cuesta llegar a gaseoso porque tiene que romper puentes de hidrógeno y luego vibrar.
IV)Elevado punto de fusión y baja densidad en estado sólido.
Punto de fusión es aquella temperatura en la que se pasa al estado sólido (0ºC).
La masa determina el estado físico del agua.
Se explica por el dipolo o los puentes de hidrógeno.
El agua, en estado líquido, tiene enlaces, por lo tanto, forman tetraedros. Cuando las moléculas dejan de agitarse se hacen sólidos fácilmente, se congelan permanentemente y los enlaces son fijos.
La consecuencia para el ser vivo es que tenemos los tres estados físicos del aguan en la Tierra a las temperaturas existentes. Permite el ciclo del agua, el clima.
En estado sólido el agua tiene baja densidad. Cualquier sólido en general, es más denso que la misma sustancia líquida, excepto el agua.
Hacen tetraedros, líquido, amontonan, rompen y forman puentes de hidrógeno; en estado sólido se quedan fijos, se forma estructura cristalina y existe aire. En estos huecos, el aire entre las moléculas baja la densidad, pro eso el hielo flota en el agua.
Su consecuencia es que el fondo del mar es líquido hasta en el polo y esto permite la vida en los mares fríos.
V) Elevada tensión superficial.
Es la resistencia que pone un líquido a la introducción de un sólido en su interior.
Se debe a los dipolos y puentes de hidrógeno.
Es una medida de los enlaces que hay entre las moléculas o cohesión molecular.
Para que un cuerpo flote necesita más volumen que peso. Su consecuencia es el ascenso de la savia bruta por capilaridad.
Ésto permite los movimientos celolares por corrientes citoplasmáticas que arrastran todo el citoplasma.
VI) Disolvente universal.
De las sustancias polares, debido al dipolo.
Aislan las cargas, rompe enlaces iónicos y se disuelven.
El agua actúa en el medio interno donde se disuelven elevadas moléculas orgánicas que son polares.
También actúa como medio de trasnporte (sangre).
Afecta a las sustancias apolares a las que no se disuelve (huyen del agua). Determina la forma de las moléculas apolares.
Todas estas propiedades parece que son pasivas proque el agua no hace nada, pero el agua si trabaja dentro del ser vivo. Tiene un papel activo, porque interviene en reacciones químicas como la HIDRATACIÓN (combinar con agua), HIDRÓLISIS (romper enlaces con agua), REDOX (óxido-reducción, como la fotosíntesis) y SÍNTESIS DE ÁC. GRASOS.
2.3 Discoluciones y dispersiones acuosas.
El medio interno está formado por agua y otras cosas:
H2O + sustancia soluble pequeña = DISOLUCIÓN (sales minerales)
H2O + sustancia +/- soluble +/- pequeña = DISPERSIONES o coloides
H2O + sustancia insoluble grande = SUSPENSIÓN (orgánulos)
En las disoluciones, nos encontramos con un disolvente y un soluto.
En las dispersiones, nos encontramos con la fase dispersante (que actúa como disolvente) y la fase dispersa ( que actúa como soluto).
Son turbias. No sedimentan con la agitación térmica y las cargas del mismo signo. Son filtrables.
La fase dispersa tiene tamaño medio y son más o menos insolubles. Aunque son insolubles, por su pequeño tamaño, forma una dispersión homogénea.
Las propiedades de las dispersiones, disoluciones y suspensiones acuosas son vitales para el mantenimiento de la constancia de variables físico-químicas del medio interno. La homeostasis hace a los seres vivos mas independientes del medio externo, y por lo tanto, están más adaptados y más evolucionados.
Las dispersiones se clasifican según las fases:
- Si se trata de un sólido o líquido disperso en gas, hablamos de AEROSOL.
- Sólido disperso en gas, HUMO.
- Líquido disperso en gas, NUBES / NIEBLA.
- Si predomina un sólido sobre un líquido, se forma el GEL ( flan, baño, jalea, gelatina).
- Si predomina un líquido sobre un sólido, se forma SOL (hialoplasma, tinta, pintura).
Lo que más se parece al medio interno es el "sol" o también conocido como CITOSOL.
La EMULSIÓN es una dispersión resultante de la mezcla de dos líquidos inmiscibles y además, un agente emulsionante (jabón).
2.4 Ósmosis y presión osmótica.
La difusión es el movimiento espontáneo de las moléculas, desde que se forma una disolución o dispersión hasta que se igualan las concentraciones.
Para que se igualen las concentraciones, hay que empujar las moléculas, y el encargado de hacerlo es la presión osmótica. Es el principal mecanismo de transporte de los seres vivos.
Aparece un caso especial, ósmosis, ya que el soluto (por la membrana semipermeable) no puede pasar a través de ella para la derecha, pues es el agua el que la atraviesa para la izquierda, pero jamás se igualarán las concentraciones porque o pasa el soluto al otro lado, o todo el agua a ala derecha, y eso es imposible. El agua pasará a la izquierda hasta que la presión osmótica sea igual a la presión hidrostática.
En un medio hipertónico, la célula se muere por la pérdida de agua, y en un medio hipotónico, la célula llega a explotar por el incremento de agua en la célula, llamado PLASMOLISIS.
Como esto no se puede consentir, el orgnismo intenta que el medio sea ISOTÓNICO (equilibrado).
2.5 Producto iónico del agua. Escala de PH.
El agua es un electrolito débil. Tanto que, 1 de cada 550 millones de moléculas de agua se ionizan. Se debe a las fuerzas de los puentes de hidrógeno.
Es una reacción inverosímil (luego vuelven a ser independientes). Cuando se da el equilibrio a 25ºC, la concentración de cargas negativas por la concentración de cargas positivas, se conoce como producto iónico del agua.
Ya que 1*10^-14 es una constante, si elevamos la concentración de OH, necesariamente disminuye la concentración de H.
Neutra ->
Como referencia para medir la acidez o alcalinidad de una disolución.
Para no tratar con potencias de 10, se introduce el concepto de PH.
Un ácido o una base en disolución se ioniza / disocia. (reacción reversible).
Los ácidos fuertes tienen mayor constante de equilibro = K, los débiles, menor K.
Un ácido fuerte, cuando se pone en agua se ioniza completa e instantáneamente, siempre están cargados.
Los débiles (que se encuentran en los seres vivos) con baja cte de equilibroi, en una disolución, no se ionizan.
Los ácidos/bases débiles, ¿están ionizados? Es importante para determinar la forma y la función de las moléculas orgánicas.
Se puede saber aplicando el concepto de PK, que es el valor de PH en el que el ácido o base débil está mitad disociado y mitad sin disociar.
Por debajo del valor de PK, predomina la sin carga y por encima la forma con carga, sabiendo el PK, conocemos el nivel de organización.
PH neutro = 7; el nuestro no se puede cambiar, porque cambiarían las cargas y el funcionamiento. De esto se encarga la homeostasis, solo se permite un cambio aproximado de 0,1 por encima y 0,1 por abajo.
Continuamente, nuestro metabolismo obtiene cargas positivas que disminuyen el PH y cargas negativas que lo aumentan, para esto se utilizan unos TAMPONES que anulan las cargas.







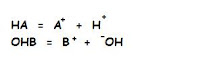


No hay comentarios:
Publicar un comentario